Der Säure-Basen-Haushalt ist ein fundamentales Konzept in der Chemie und hat auch eine große Bedeutung für unseren Körper. In diesem Artikel werden wir uns mit den Grundlagen des Säure-Basen-Haushalts beschäftigen und erfahren, wie der pH-Wert gemessen und berechnet wird.
Der pH-Wert: Eine Einführung
Der pH-Wert ist eine dimensionslose Größe, die den Säuregehalt einer Lösung angibt. Er reicht von 0 (stark sauer) über 7 (neutral) bis hin zu 14 (stark basisch). Ein niedriger pH-Wert deutet auf eine saure Lösung hin, während ein hoher pH-Wert auf eine basische Lösung hinweist.
Bei Zugabe einer Säure zu einer Lösung wird sie sauer, da die Säure ihre Protonen auf die Wassermoleküle überträgt und dadurch mehr H3O+-Ionen als OH–Ionen entstehen. Bei Zugabe einer Base wird die Lösung hingegen basisch, da die Base Protonen von den Wassermolekülen aufnimmt und somit mehr OH–Ionen als H3O+-Ionen vorhanden sind.
Die Berechnung des pH-Werts
Die Berechnung des pH-Werts hängt von der Stärke der Säure bzw. Base ab. Es gibt verschiedene Formeln für starke und schwache Säuren sowie Basen.
Starke Säuren
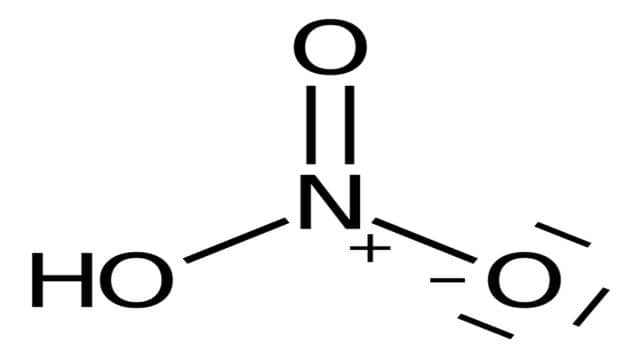
Für starke Säuren wie Salzsäure, Schwefelsäure oder Salpetersäure wird folgende Formel verwendet: pH = −lg([Säure] × Wertigkeit). Zum Beispiel ergibt eine 0,05-molare HCl-Lösung einen pH-Wert von etwa 1,3.
Schwache Säuren
Für schwache Säuren wie Kohlensäure oder Essigsäure gilt die Formel: pH = ½ (pKS – lg[Säure]). Eine 0,1-molare Essigsäurelösung mit einem pKS-Wert von 4,8 hat einen pH-Wert von etwa 2,9.
Starke Basen
Bei starken Basen wie dem Hydroxid-Ion wird die pOH-Formel verwendet: -lg ([Base] × Wertigkeit). Der pH-Wert kann dann mit der Formel pH = 14 – pOH berechnet werden. Eine 0,01-molare Kaliumhydroxidlösung hat beispielsweise einen pH-Wert von 12.
Schwache Basen
Schwache Basen wie Ammoniak haben die Formel pH = 14 − ½ (pKB − lg[Base]). Eine 0,1-molare Ammoniaklösung mit einem pKB-Wert von 4,75 hat einen pH-Wert von etwa 11,12.
Die Autoprotolyse des Wassers
Wasser kann ein Proton auf ein anderes Wassermolekül übertragen und wird dabei sowohl als Säure als auch als Base aktiv. Dieser Vorgang wird als Autoprotolyse des Wassers bezeichnet. Die Reaktionsgleichung lautet: H2O + H2O ⇄ H3O+ + OH-.
Diese Autoprotolyse des Wassers ermöglicht es, den pH-Wert von reinem Wasser zu berechnen. Das Ionenprodukt des Wassers (KW) ist das Verhältnis von OH– und H3O+-Ionen in stark verdünnten Lösungen und beträgt 10^-14 mol^2/L^2. In reinem Wasser sind die Konzentrationen von OH– und H3O+-Ionen gleich, beide betragen 10^-7 mol/L. Das Ionenprodukt des Wassers kann auch genutzt werden, um die pK-Werte eines korrespondierenden Säure-Basen-Paares zu berechnen: pKW = pKS + pKB = 14.
Neutralisation und der pH-Wert von Salzlösungen
Bei einer Neutralisation reagieren gleiche Mengen an Säure und Base miteinander und erzeugen Wasser und Salz. Der pH-Wert dieser resultierenden Lösung hängt von der Stärke der Säure und Base ab. Nicht alle Salzlösungen haben einen neutralen pH-Wert von 7.
Als Beispiel betrachten wir die Reaktion von Natriumacetat, einer schwachen Base, mit Essigsäure, einer schwachen Säure. Das entstehende Natriumacetat ist schwach basisch. Der pH-Wert einer 0,1-molaren Natriumacetatlösung mit einem pKB-Wert von 9,25 beträgt etwa 8,875.
Titration
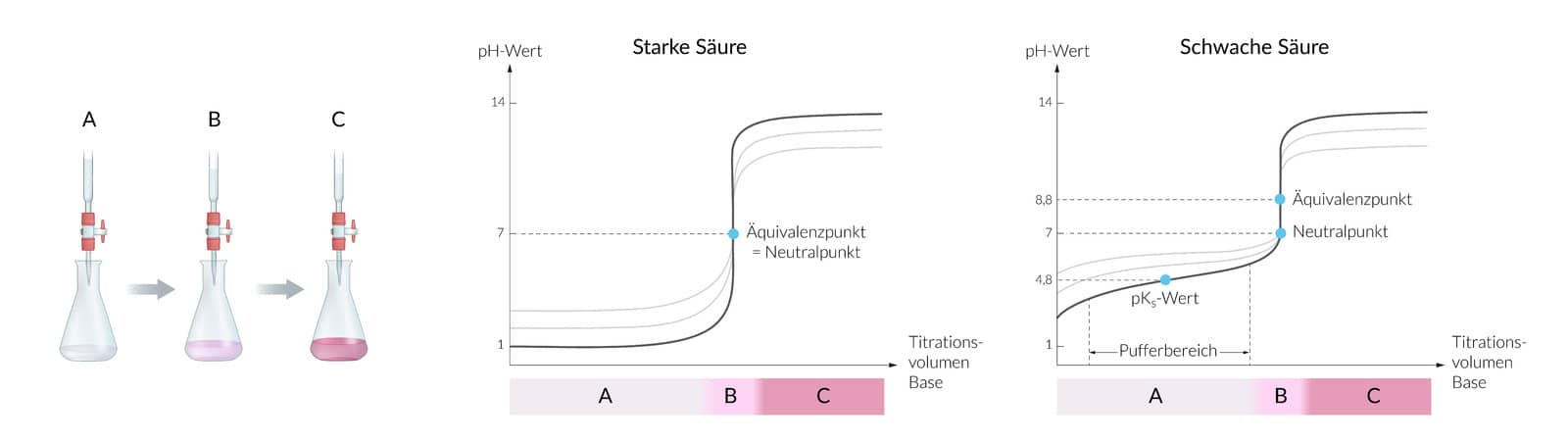
Titration ist ein Verfahren zur Bestimmung der Menge an Säure oder Base in einer Lösung. Dabei werden genau dosierte Mengen einer Base oder Säure hinzugegeben und die Änderung des pH-Werts mithilfe eines Indikators gemessen.
Es gibt zwei Arten der Titration: Azidimetrie und Alkalimetrie. Bei der Azidimetrie wird eine bekannte Menge Säure zu einer unbekannten Menge Base gegeben, um die Basenmenge zu berechnen. Bei der Alkalimetrie wird eine bekannte Menge Base zu einer unbekannten Menge Säure hinzugefügt, um die Säuremenge zu berechnen.
Während der Titration wird der pH-Wert nach jeder Zugabe des Titrationsmittels gemessen und in einer Titrationskurve aufgetragen. Besondere Punkte in der Kurve sind der Äquivalenzpunkt, der Halbäquivalenzpunkt und der Neutralpunkt. Der Äquivalenzpunkt ermöglicht die Berechnung der gesuchten Säure- oder Basenmenge.
So, jetzt kennst du die Grundlagen des Säure-Basen-Haushalts und wie der pH-Wert berechnet wird. Es ist unglaublich faszinierend, wie diese chemischen Prozesse sowohl in unserem Körper als auch in der Natur ablaufen. Wenn du deinen Körper und seine Funktionsweise besser verstehen möchtest, ist das Verständnis des Säure-Basen-Haushalts ein guter Anfang!