Amin-Verbindungen sind ein faszinierendes Thema in der organischen Chemie. Ihre reaktive Eigenschaften und ihr Verhalten als Basen machen sie zu einer wichtigen Komponente vieler chemischer Reaktionen. In diesem Artikel werden wir uns mit der Basisizität von Aminen befassen und untersuchen, was die Basisizität eines Amins bestimmt.
Die Basisizität von Stickstoffgruppen
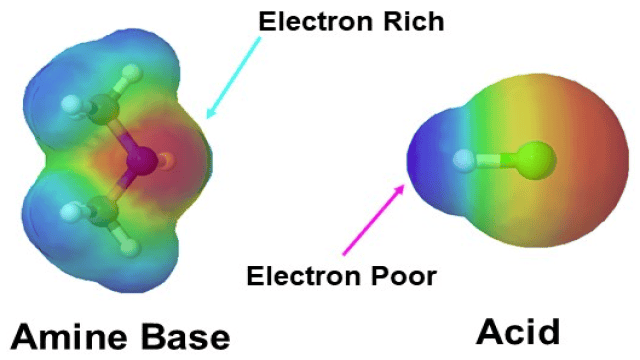
Die Basisizität von Aminen hängt von der Reaktivität des freien Elektronenpaares am Stickstoffatom ab. Je reaktiver dieses Elektronenpaar ist, desto basischer und nukleophiler ist das Amin. Dieses Elektronenpaar verleiht dem Stickstoff eine hohe Elektronendichte, die in der elektrostatischen Potentialkarte unten links in Rot dargestellt wird. Aminverbindungen sind basisch und reagieren leicht mit den Wasserstoffatomen von Säuren, die eine niedrige Elektronendichte aufweisen.

Bildnachweis: Video amide amine unterschied basisch
Aminverbindungen reagieren mit Wasser, um ein Gleichgewicht herzustellen, bei dem ein Proton an das Amin übertragen wird und ein Ammoniumsalz und das Hydroxid-Ion entstehen, wie in der folgenden allgemeinen Gleichung gezeigt wird:
[RNH2(aq) + H2O(l) ⇌ RNH3+(aq) + OH−(aq)]Das Gleichgewichtsverhältnis für diese Reaktion wird als Base-Ionisierungskonstante (Kb) bezeichnet. Ähnlich wie bei der Säurestärke einer Carbonsäure kann die Basestärke eines Amins durch eine analoge Basizitätskonstante Kb gemessen werden. Je größer der Kb-Wert und je kleiner der pKb-Wert ist, desto günstiger ist das Protonen-Transfer-Gleichgewicht und desto stärker ist die Base.
Es ist jedoch üblich, die Basizität von Aminen anhand der Konjugationsbasen (entsprechende Ammoniumionen) zu vergleichen, anstatt Kb-Werte zu verwenden. Glücklicherweise sind die Ka- und Kb-Werte für Amine direkt miteinander verbunden. Wenn der Ka-Wert für ein Ammoniumion bekannt ist, kann der Kb-Wert für das entsprechende Amin mit der Gleichung Kb = Kw / Ka berechnet werden. Diese Beziehung zeigt, dass sich das Amin umso schwächer verhält, je saurer das Ammoniumion wird (Ka-Wert nimmt zu, pKa-Wert nimmt ab).
Die Bedeutung von Substituenten
Die Basestärke von Aminen kann durch Substituenten stark beeinflusst werden. Einfache Alkylamine haben in der Regel pKa-Werte im Bereich von 9,5 bis 11,0 und ihre wässrigen Lösungen sind basisch mit einem pH-Wert von 11 bis 12, abhängig von der Konzentration.
Aromatische heterocyclische Amine (wie Pyrimidin, Pyridin, Imidazol, Pyrrol) sind als Folge von drei Faktoren deutlich schwächere Basen. Der erste Faktor ist die Hybridisierung des Stickstoffs. In jedem Fall ist der heterocyclische Stickstoff sp2-hybridisiert. Durch den zunehmenden s-Charakter nähert er sich dem Stickstoffkern an und verringert seine Bindungsneigung zu einem Proton im Vergleich zu sp3-hybridisierten Stickstoffen. Die sehr geringe Basizität von Pyrrol spiegelt die außergewöhnliche Delokalisierung des Stickstoffelektronenpaares wider, das mit seiner Einbindung in einen aromatischen Ring verbunden ist. Imidazol ist über eine Million Mal basischer als Pyrrol (pKa = 6,95), weil der sp2-hybridisierte Stickstoff, der Teil einer Doppelbindung ist, strukturell ähnlich wie Pyridin ist und eine vergleichbare Basizität aufweist.
Zusammenfassung
In diesem Artikel haben wir die Grundlagen der Amin-Basisizität behandelt. Wir haben gesehen, dass die Reaktivität des freien Elektronenpaares am Stickstoffatom die Basisizität von Aminen bestimmt. Wir haben auch untersucht, wie Substituenten die Basestärke von Aminen beeinflussen können. Aminverbindungen sind wichtige Bausteine in der organischen Chemie und ihr Verständnis ist entscheidend für das Verständnis vieler chemischer Reaktionen.