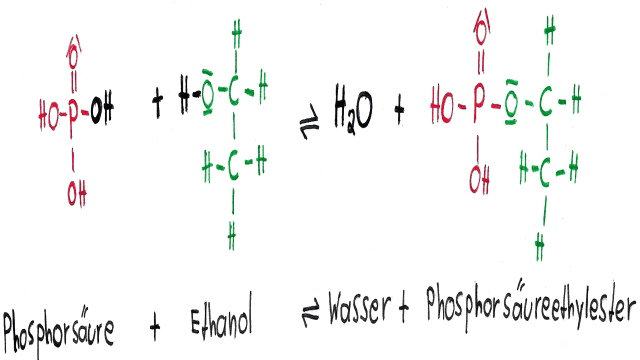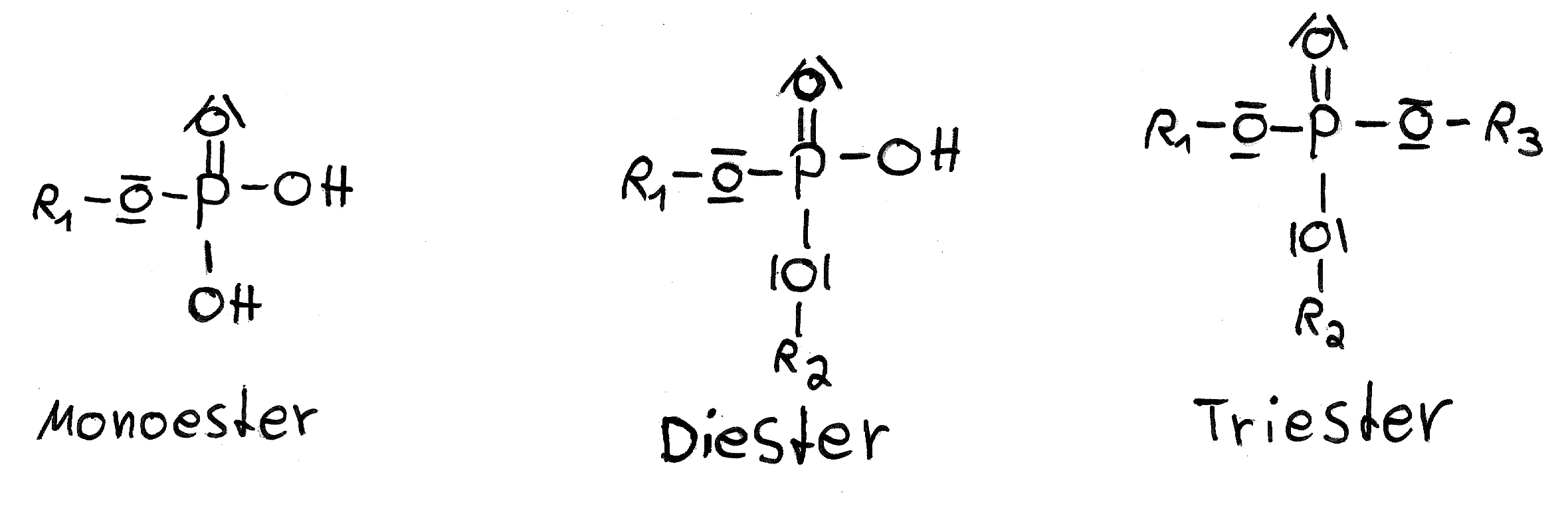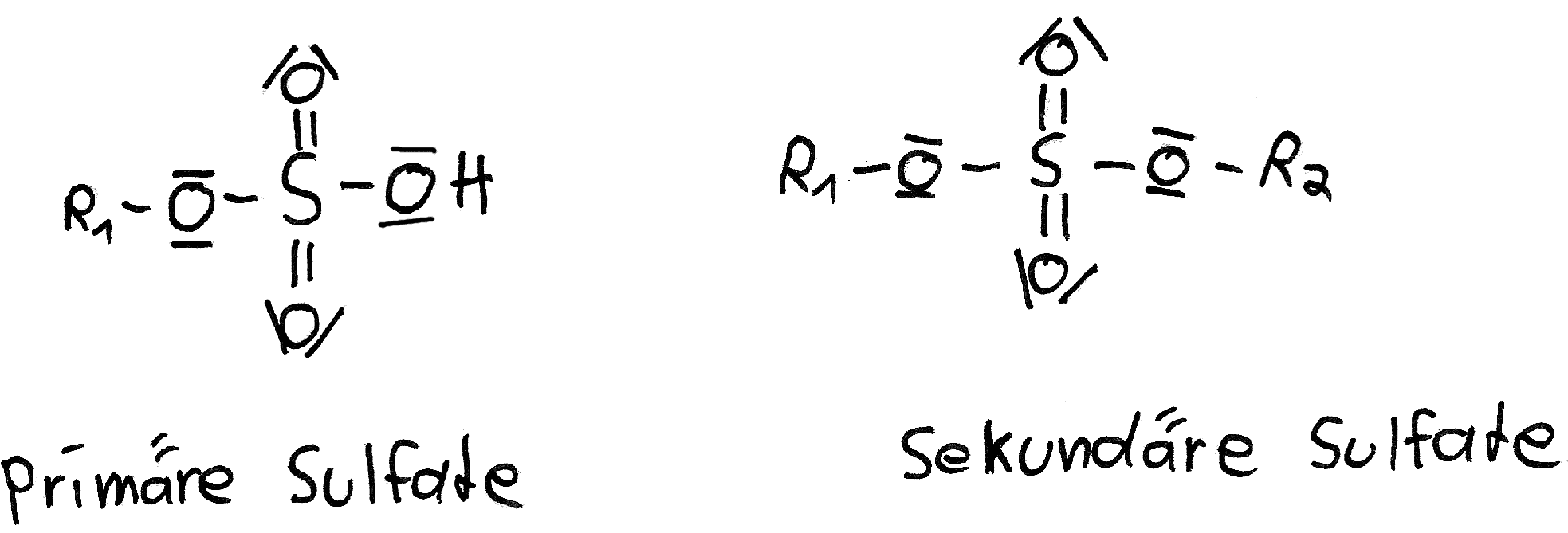Die Welt der organischen Chemie ist faszinierend und vielfältig. Eine wichtige Gruppe chemischer Verbindungen sind die Ester. Ester entstehen durch die Reaktion einer Säure und eines Alkohols unter Abspaltung von Wasser. Dabei gibt es sowohl Ester von organischen Säuren wie Essigsäure und Ameisensäure als auch von anorganischen Säuren wie Phosphorsäure, Schwefelsäure und Kohlensäure. Interessanterweise ähneln sich die anorganischen Ester und die organischen Ester in vielen Punkten.
Phosphorsäureester
Phosphorsäure ist in der Lage, drei Hydroxidgruppen zu besitzen und somit Phosphorsäureester zu bilden. Diese Ester sind leicht hydrolysierbar, was bedeutet, dass sie durch Wasser spaltbar sind. Sie sind auch leicht enzymatisch und abiotisch abbaubar. Einige Phosphorsäureester sind sehr gut fettlöslich (lipophil) und weisen eine hohe Toxizität auf. Dadurch benötigt man nur geringe Mengen dieser Ester. Ein weiterer Vorteil der Phosphorsäureester ist ihre große Variabilität. Es sind viele verschiedene Verbindungen möglich, was die Entstehung von Resistenzen vermindert. Industriell hergestellte Phosphorsäureester werden in Kunststoffen und Lacken als Weichmacher, Flammschutzmittel und Härter eingesetzt. Sie dienen auch als Beiz- und Haftmittel beim Aufbringen von Farben und Lacken sowie in der Metalloberflächenbehandlung. Ebenso finden sie Verwendung als Hilfsmittel für Textilien und Papier, als Putz- und Reinigungsmittel sowie als Öl- und Treibstoffadditive. Es ist jedoch zu beachten, dass einige Phosphorsäureester, wie das berühmte E605 (Parathion), als starke Insektengifte bekannt sind. Phosphorsäureester wurden auch als Nervengift in hochtoxischen chemischen Kampfstoffen eingesetzt. Bekannte Vertreter sind Sarin, Tabun und Soman. Interessanterweise findet man Phosphorsäureester auch in der Natur, zum Beispiel in der DNA.
Schwefelsäureester (Sulfate)
Ähnlich wie Phosphorsäure bildet auch Schwefelsäure Ester. Schwefelsäureester sind in der lebendigen Natur weit verbreitet. Sie sind zum Beispiel Bestandteil von Carrageen, einer Substanz, die in der Gehirnsubstanz vorkommt. Schwefelsäureester finden sich auch in Tensiden (Alkylsulfaten) und in kosmetischen Produkten. Dimethylsulfat und Diethylsulfat werden in der chemischen Industrie als Ausgangsstoffe für Synthesen verwendet und sind kräftige Alkylierungsmittel. Manchmal werden Schwefelsäureester auch als Sulfate bezeichnet, da ihre Namen häufig auf “-sulfat” enden. Die meisten Sulfate sind in Wasser löslich, aber es gibt auch Ausnahmen. Einige Sulfate der Erdalkalimetalle wie Calciumsulfat, Strontiumsulfat, Bariumsulfat und Radiumsulfat sowie Blei(II)-sulfat sind wenig oder schwer löslich. Tatsächlich ist Radiumsulfat das schwerlöslichste bekannte Sulfat. Die Alkali- und Erdalkalisulfate sind thermisch äußerst stabil. Sulfate dreiwertiger Metallkationen zersetzen sich bei Hitze zu den entsprechenden Oxiden und Schwefeltrioxid. Viele Metallsulfate kommen in Form von Mineralen in der Natur vor. Das bekannteste davon ist Calciumsulfat (Gips). Sulfate werden auch biologisch aus Sulfiden und schwefelhaltigen Biomasse-Bestandteilen wie Proteinen durch schwefeloxidierende Bakterien gebildet. Im Grundwasser sind Sulfate in unterschiedlichen Mengen vorhanden.
Wie du siehst, spielen anorganische Ester eine wichtige Rolle in der Welt der Chemie. Obwohl sie sich von organischen Estern unterscheiden, können sie ähnliche Eigenschaften und Anwendungen haben. Es lohnt sich, weiter in dieses faszinierende Thema einzutauchen!