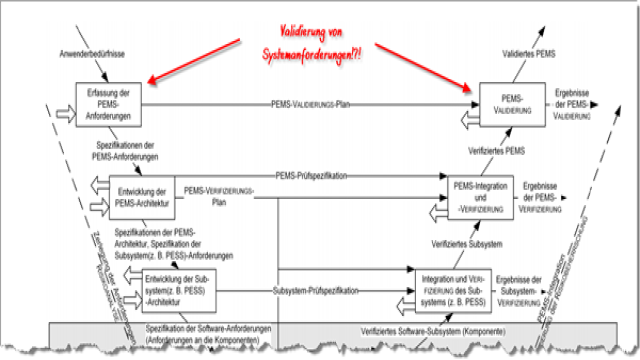
Selbst Normen und Gesetze verwenden die Begriffe Verifizierung und Validierung falsch oder missverständlich. Aber wie unterscheiden sich diese beiden Begriffe und wie sind sie definiert? In diesem Artikel erfahren Sie alles Wichtige über die präzise Verifizierung und Validierung von Medizinprodukten.
Verifizierung
a) Definition
Bei der Verifizierung werden Anforderungen an Produkte oder Komponenten bestätigt. Die Verifizierung bestätigt also, ob bestimmte Eigenschaften oder Merkmale eines Produkts oder Komponente den festgelegten Anforderungen entsprechen. Diese Anforderungen können beispielsweise in einer System Requirements Specification (SRS) oder in den Komponentenanforderungen spezifiziert sein.
b) Beispiele
Einige Beispiele für spezifizierte Merkmale sind:
- Spezifikation der Benutzerschnittstelle durch Mockups oder Zeichnungen.
- Verhalten des Systems an den Datenschnittstellen, einschließlich Interoperabilität.
- Verhalten des Systems an “Patientenschnittstellen” (Anwendungsteil), z.B. eine spezifizierte Spannung in einer bestimmten Pulsfolge an einem Defibrillator.
c) Sonderfall: Verifizierung der Gebrauchstauglichkeit
Die Verifizierung der Gebrauchstauglichkeit ist der Nachweis, dass spezifizierte Produktmerkmale mit Bezug auf die Gebrauchstauglichkeit erfüllt sind. Sie ist also eine Untermenge der Verifizierung und wird von der IEC 62366 gefordert. Beispiele für spezifizierte Produktmerkmale sind Schriftgrößen, Farben, Kontrastverhältnisse oder allgemeine Regeln wie das Markieren von Pflichtfeldern. Die Verifizierung der Gebrauchstauglichkeit erfolgt in Form von Inspektionen durch Usability-Experten.
Möchten Sie mehr über die Verfahren zur Verifizierung und Validierung der Gebrauchstauglichkeit erfahren? Dann empfehlen wir Ihnen das Seminar “Usability & Requirements” von Thomas Geis.
Validierung
a) Definition
Die Validierung stellt sicher, dass die Anforderungen für einen bestimmten Gebrauch erfüllt sind. Die Erfüllung der Anforderungen hängt dabei von den Nutzern und dem Nutzungskontext ab. Die Validierung ist also der objektive Nachweis, dass ein spezifizierter Nutzer im spezifizierten Nutzungskontext seine spezifizierten Nutzungsziele erreichen kann.
b) Beispiele
Die Validierung hat zwei Aspekte:
- Klassische Validierung: Hierbei wird geprüft, ob ein Medizinprodukt seine Nutzungsziele überhaupt erreichen kann. Die klinische Bewertung ist ein Beispiel für eine solche Validierung.
- Validierung der Gebrauchstauglichkeit: Hierbei wird geprüft, ob die spezifizierten Nutzer im spezifizierten Nutzungskontext die Nutzungsziele effektiv, effizient und zufriedenstellend erreichen können. Diese Prüfung erfolgt üblicherweise in Form einer summativen Evaluation, z.B. durch Usability Tests.
Verifizierung und Validierung bei Software
Bei Produkten, zu denen Software gehört, fordern die MDR und die IVDR die Verifizierung und Validierung der Software entsprechend dem Stand der Technik. Um die Anforderungen für Verifizierung und Validierung zu erfüllen, wenden Hersteller üblicherweise die IEC 62304 an.
Verifizierung
Die Verifizierung von Software erfolgt durch Unit-Tests, Integrationstests, Software-Systemtests, Code-Reviews und statische Code-Analyse.
Validierung
Die wichtigsten Methoden zur Validierung von (Standalone-)Software sind die Validierung der Gebrauchstauglichkeit durch Usability Tests und die klinische Bewertung, welche ggf. klinische Prüfungen bedingen kann.
Eine wertvolle Ergänzung liefert das Guidance-Dokument MDCG 2020-1.
Typische Fallen
In Bezug auf Verifizierung und Validierung gibt es einige typische Missverständnisse und Fehler, die vermieden werden sollten.
Verwechslung der verschiedenen “Validierungen”
Der Begriff “Validierung” wird oft in verschiedenen Kontexten verwendet und kann leicht verwechselt werden. Es ist wichtig, die verschiedenen Arten der Validierung zu verstehen, wie beispielsweise die Validierung im engeren Sinn und die Validierung im weiteren Sinn.
Verzicht auf die Verifizierung bei Sicherheitsklasse A
Früher war es möglich, bei Sicherheitsklasse A auf eine Verifizierung zu verzichten. Die MDR hat jedoch diese Regelung geändert, und jetzt sind zumindest Software-Systemtests erforderlich, unabhängig von der Sicherheitsklasse.
Verwechslung von Verifizierung und Validierung
Es ist wichtig, den Unterschied zwischen Verifizierung und Validierung klar zu verstehen und sie nicht zu verwechseln, um präzise Ergebnisse zu erzielen.
Irrglaube, dass eine erfolgreiche Verifizierung die Voraussetzung für eine erfolgreiche Validierung ist
Die Ergebnisse von Verifizierung und Validierung können unabhängig voneinander sein. Es ist möglich, dass die Verifizierung erfolgreich ist und die Validierung nicht, oder umgekehrt.
Verifizierung nur des Produkts bzw. dessen Komponenten
Nicht nur das Produkt und seine Komponenten müssen verifiziert werden, sondern auch die Entwicklungsdokumente, die während der konstruktiven Phase entstehen.
Unterstützung
Eine erfolgreiche Verifizierung und Validierung ist entscheidend für die Zulassung von Medizinprodukten. Um Probleme zu vermeiden, stehen zahlreiche Hilfestellungen zur Verfügung, wie das kostenlose Starter-Kit des Johner Instituts, Artikel zu Software-Systemanforderungen und Validierung von Software als Medizinprodukt, das Seminar “Usability, Requirements und IEC 62366” und die Usability Labs des Johner Instituts.