Der klinische Studienbericht, auch bekannt als Clinical Study Report (CSR), ist ein wichtiges Dokument für die Arzneimittelzulassung. In diesem Artikel möchten wir Ihnen zeigen, wie Sie qualitativ hochwertige CSRs effizient erstellen können.
Die Planung
Eine gute Kommunikation zwischen Auftraggeber und Medical Writer ist der Schlüssel zum Erfolg bei der Erstellung eines CSRs. Es ist wichtig, dass die Wünsche des Auftraggebers zu Beginn des Projekts klar kommuniziert werden, um einen Zeitplan zu erstellen. Dieser Zeitplan hängt von verschiedenen Faktoren wie der Komplexität der statistischen Auswertungen, der Studienphase und der Anzahl der Studienteilnehmer ab. Der endgültige Termin für die Fertigstellung des CSRs wird vom Auftraggeber festgelegt. Um den Schreibprozess effektiv zu planen, sollten relevante Meilensteine der Studie berücksichtigt werden, wie das Schließen der Datenbank oder die Verfügbarkeit der statistischen Auswertungen. Es ist ratsam, mit dem Schreiben der Kapitel zu beginnen, die nicht auf den statistischen Auswertungen basieren.
Die Vorbereitung
Bevor Sie mit dem Verfassen des Studienberichts beginnen, sollten Sie sich ein umfassendes Wissen über die Studie aneignen. Lesen Sie den Prüfplan aufmerksam durch, um Informationen über den Ablauf der Studie, die Ein- und Ausschlusskriterien und das Studiendesign zu erhalten. Der statistische Analyseplan (SAP) ist für die Interpretation und Diskussion der Studienergebnisse von entscheidender Bedeutung. Wenn möglich, können Sie auch einen Biostatistiker zur Unterstützung hinzuziehen. Eine Checkliste kann Ihnen helfen, einen Überblick über fehlende Dokumente zu behalten und benötigte Informationen schnell anzufordern.
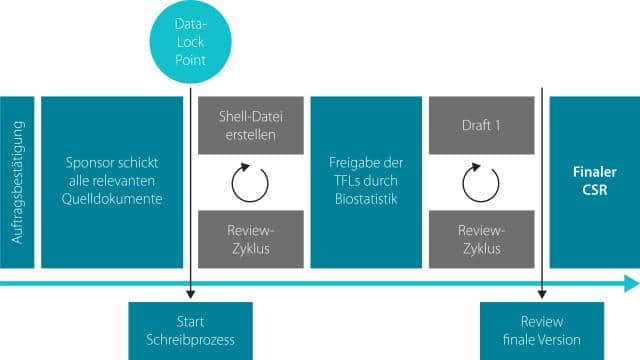
Der Schreibprozess bis zum finalen Dokument
Um den CSR zu verfassen, sollten Sie zunächst eine Vorlage erstellen, die schrittweise mit Inhalt gefüllt wird. Diese Vorlage kann entweder vom Sponsor bereitgestellt werden oder vom Medical Writer selbst erstellt werden, unter Berücksichtigung der entsprechenden Richtlinien. Anschließend wird eine “Shell-Datei” erstellt, in der formale Aspekte wie Informationen zu den Prüfzentren und Ethikkommissionen sowie zur Studiendurchführung und statistischen Auswertung festgehalten werden. Die Informationen werden aus dem Prüfplan und dem SAP entnommen. Es ist effizient, Passagen aus dem Prüfplan in die Vergangenheitsform zu setzen und an den entsprechenden Stellen des CSRs einzufügen. Eine vollständige Shell-Datei sollte von einem weiteren Medical Writer auf Vollständigkeit und Korrektheit überprüft werden. Der nächste Schritt besteht darin, einen ersten Entwurf des CSR zu erstellen, der die Kapitel “Ergebnisse”, “Sicherheit” und “Diskussion” umfasst. Tabellen können verwendet werden, um ausgewählte Ergebnisse aus den statistischen Auswertungen zusammenzufassen. Der Entwurf wird an den Sponsor zur Überarbeitung zurückgeschickt, bis eine finale Version erreicht ist. Diese finale Version wird in der Regel bei den zuständigen Behörden eingereicht und kann in Teilen der Öffentlichkeit zugänglich gemacht werden.
Fazit
Das Schreiben eines CSR erfordert viele Schritte und eine gründliche Vorbereitung. Neben der guten Kommunikation zwischen Medical Writer und Auftraggeber ist eine gute Zeitplanung für das Projekt unerlässlich. Ein Medical Writer sollte auch im Blick behalten, dass der CSR nicht nur von der Behörde, sondern auch von der Öffentlichkeit gelesen wird. Wenn Sie Unterstützung beim Schreiben von CSRs benötigen, stehen wir Ihnen gerne zur Verfügung. Kontaktieren Sie uns!